ГЛАВА 3. Физико-химические основы процессов взаимодействия активных частиц плазмы с поверхностью
4. Кинетика взаимодействия ХАЧ с поверхностью
При рассмотрении метода сложения сопротивлений в предыдущем разделе полагалось, что взаимодействие ХАЧ с поверхностью состоит только из одной стадии – собственно химической реакции. Это являлось упрощением реальной ситуации, так как гетерогенное взаимодействие включает в себя три последовательные стадии - адсорбцию ХАЧ на поверхности, химическую реакцию и десорбцию образующихся продуктов реакции, каждая из которых может быть лимитирующей. Другими словами, протекание процесса травления в кинетическом режиме строго означает лишь то, что его скорость не лимитируется объемными процессами. В то же время реальная кинетика процесса травления будет определяться закономерностями протекания наиболее медленной из трех названных гетерогенных стадий.
Для описания кинетики взаимодействия ХАЧ плазмы с поверхностью часто используется адсорбционно-десорбционная модель гетерогенного процесса, основанная на теории активных центров Лангмюра-Хиншельвуда. Поверхность обрабатываемого материала рассматривается как совокупность активных центров – минимумов поверхностной энергии, способных присоединять (адсорбировать) ХАЧ из объема плазмы. Попадающая на поверхность ХАЧ адсорбируется с вероятностью, зависящей от природы частиц, температуры и состояния поверхности. Далее, в зависимости от состояния поверхности, определяемого летучестью продуктов взаимодействия, могут реализоваться два направления последовательных процессов. В первом случае, если адсорбция ХАЧ происходит на свободных активных центрах, то в качестве следующего этапа будет выступать процесс химического взаимодействия ХАЧ с поверхностью с образованием продуктов реакции. Во втором случае, при адсорбции ХАЧ на слое продуктов реакции, происходит либо рекомбинация ХАЧ без взаимодействия с поверхностью, либо химическая реакция предваряется диффузией активных частиц через слой продукта. В качестве заключительной стадии следует рассматривать газификацию (десорбцию) продуктов взаимодействия, которая может быть спонтанной (термически активированной), либо требует дополнительной активации.
Адсорбция ХАЧ сорта ![]() на поверхности
на поверхности ![]() :
:
| (1) |
может
протекать по двум механизмам – физическому (физисорбция) и химическому
(хемосорбция). Физисорбция является следствием слабых ван-дер-вальсовских сил
притяжения между частицей и поверхностью. Процесс имеет слабо экзотермический
характер с ![]() ~ 1 – 25 кДж/моль, при этом глубина потенциальной ямы, отвечающей
адсорбированному состоянию составляет 0.01 – 0.25 эВ. Из-за слабой связи с
поверхностью адсорбированные частицы обладают высокой подвижностью –
способностью к миграции. В отличии от физисорбции, хемосорбция сопровождается
образованием химической связи между адсорбирующейся частицей и поверхностью.
Процесс хемосорбции является сильно экзотермическим с
~ 1 – 25 кДж/моль, при этом глубина потенциальной ямы, отвечающей
адсорбированному состоянию составляет 0.01 – 0.25 эВ. Из-за слабой связи с
поверхностью адсорбированные частицы обладают высокой подвижностью –
способностью к миграции. В отличии от физисорбции, хемосорбция сопровождается
образованием химической связи между адсорбирующейся частицей и поверхностью.
Процесс хемосорбции является сильно экзотермическим с ![]() ~ 40 – 400
кДж/моль, что соответствует глубине потенциальной ямы
~ 40 – 400
кДж/моль, что соответствует глубине потенциальной ямы ![]() ~ 0.4 – 4 эВ.
При хемосорбции молекул, атомы которых имеют двойные, тройные и т.д. связи,
«присоединение» ХАЧ с поверхностью возникает с разрывом одной из этих связей
~ 0.4 – 4 эВ.
При хемосорбции молекул, атомы которых имеют двойные, тройные и т.д. связи,
«присоединение» ХАЧ с поверхностью возникает с разрывом одной из этих связей
| (2) |
при этом разрушения молекулы не происходит. Если же атомы в исходной молекуле связаны одинарной связью, то при хемосорбции может произойти распад молекулы
| (3) |
а процесс (3) носит название диссоциативной хемосорбции. Во многих системах физический и химический механизмы адсорбции реализуются параллельно, при этом конкретный режим процесса зависит от температуры поверхности и от формы потенциальных кривых, определяемых физико-химической природой поверхностных и адсорбируемых частиц.
Для недиссоциативной адсорбции в термодинамически неравновесных системах вероятность адсорбции может быть определена из теории адсорбции Лангмюра как
| (4) |
где ![]() - вероятность адсорбции
при нулевой степени заполнения поверхности адсорбатом. Выражение (4)
показывает, что хемосорбция прекратится при достижении условия
- вероятность адсорбции
при нулевой степени заполнения поверхности адсорбатом. Выражение (4)
показывает, что хемосорбция прекратится при достижении условия ![]() = 1 – это соответствует полному
заполнению активных центров абсорбированными ХАЧ в количестве монослоя. Строго
говоря, процесс на этом не останавливается, так как протекает физисорбция ХАЧ
на хемосорбированном слое, в результате чего возможно накопление адсорбата на
поверхности в количестве многих монослоев. Фактически же, в подавляющем
большинстве случаев, физисорбция компенсируется десорбционными процессами так,
что результирующий поток ХАЧ на поверхность становится равным нулю. Необходимо
отметить также, что выражение (4) обычно дает заниженные значения для
= 1 – это соответствует полному
заполнению активных центров абсорбированными ХАЧ в количестве монослоя. Строго
говоря, процесс на этом не останавливается, так как протекает физисорбция ХАЧ
на хемосорбированном слое, в результате чего возможно накопление адсорбата на
поверхности в количестве многих монослоев. Фактически же, в подавляющем
большинстве случаев, физисорбция компенсируется десорбционными процессами так,
что результирующий поток ХАЧ на поверхность становится равным нулю. Необходимо
отметить также, что выражение (4) обычно дает заниженные значения для ![]() в области средних
степеней заполнения поверхности, так как не учитывает одного простого
механизма: попадая на активный центр, занятый хемосорбированной ХАЧ, другая ХАЧ
может сначала адсорбироваться на нем по физическому механизму, а затем
мигрировать по поверхности до нахождения свободного активного центра.
в области средних
степеней заполнения поверхности, так как не учитывает одного простого
механизма: попадая на активный центр, занятый хемосорбированной ХАЧ, другая ХАЧ
может сначала адсорбироваться на нем по физическому механизму, а затем
мигрировать по поверхности до нахождения свободного активного центра.
Характер
температурной зависимости ![]() зависит от того, является ли переход от
физисорбированного к хемосорбированному состоянию пороговым процессом. Если
потенциальный барьер отсутствует, при низких температурах величина
зависит от того, является ли переход от
физисорбированного к хемосорбированному состоянию пороговым процессом. Если
потенциальный барьер отсутствует, при низких температурах величина ![]() близка к единице, но
снижается с увеличением температуры из-за снижения доли ХАЧ, которые при
попадании на поверхность теряют достаточно энергии для того, чтобы быть
захваченными в потенциальной яме адсорбированного состояния. В случае
порогового процесса величина
близка к единице, но
снижается с увеличением температуры из-за снижения доли ХАЧ, которые при
попадании на поверхность теряют достаточно энергии для того, чтобы быть
захваченными в потенциальной яме адсорбированного состояния. В случае
порогового процесса величина ![]() очень мала до достижения условия
очень мала до достижения условия ![]() ~
~ ![]() , а при
дальнейшем увеличении температуры описывается аррениусовской зависимостью
, а при
дальнейшем увеличении температуры описывается аррениусовской зависимостью
| (5) |
где
предэкспоненциальный множитель ![]() снижается с ростом температуры по причине,
указанной выше.
снижается с ростом температуры по причине,
указанной выше.
Экспериментальные
измерения вероятности адсорбции при 300 К показывают, что диапазон этой
величины очень широк 10-6 – 1 и для данной системы «ХАЧ –
поверхность» зависит от кристаллографической ориентации поверхности и ее
шероховатости. Для многих поверхностей активными центрами при адсорбции
являются поверхностные дефекты, такие как вакансии, краевые и винтовые
дислокации и др. Химические активные газы (галогенсодержащие газы, кислород) и
особенно радикалы, образующиеся при их диссоциации в плазме, адсорбируются на
металлических поверхностях с высокими вероятностями с ![]() ~ 0.1 – 1. При
адсорбции атомов водорода на поверхности
Si
~ 0.1 – 1. При
адсорбции атомов водорода на поверхности
Si ![]() ~ 1, однако для
молекул H2 эта
величина не превышает нескольких процентов, а для молекул О2 еще
меньше – 10-3 – 10-4.
~ 1, однако для
молекул H2 эта
величина не превышает нескольких процентов, а для молекул О2 еще
меньше – 10-3 – 10-4.
Десорбция представляет процесс обратный адсорбции. Предполагая, что процесс десорбции протекает по первому кинетическому порядку
| (6) |
температурная зависимость константы скорости может быть представлена в аррениусовской форме
| (7) |
где ![]() - это глубина
потенциальной ямы соответствующего адсорбированного состояния (
- это глубина
потенциальной ямы соответствующего адсорбированного состояния (![]() или
или ![]() ). Величина
). Величина ![]() также зависит от механизма
адсорбции и лежит в диапазоне 1014 – 1016 сек-1
для физисорбции и 1013 – 1015 сек-1 для
хемосорбции (табл.1). Альтернативой процессу (6) служит ассоциативная
десорбция
также зависит от механизма
адсорбции и лежит в диапазоне 1014 – 1016 сек-1
для физисорбции и 1013 – 1015 сек-1 для
хемосорбции (табл.1). Альтернативой процессу (6) служит ассоциативная
десорбция
| (8) |
которая описывается кинетическим уравнением второго порядка. Температурная зависимость коэффициента скорости качественно аналогична соотношению (7), а предэкспоненциальный множитель определяется как число столкновений между адсорбированными частицами в единицу времени на единице площади поверхности:
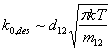 |
(9) |
где ![]() и
и ![]() - средний диаметр и приведенная
масса сталкивающихся частиц:
- средний диаметр и приведенная
масса сталкивающихся частиц: ![]() и
и ![]() . Обычно для ассоциативной десорбции величина
. Обычно для ассоциативной десорбции величина
![]() лежит в
диапазоне 10-3–1 см2/сек.
лежит в
диапазоне 10-3–1 см2/сек.
Таблица 1
Параметры уравнения (7) при десорбции атомов галогенов
|
Поверхность |
Десорбируемая частица |
|||||
|
Cl |
Br |
F |
||||
|
|
|
|
|
|
|
|
|
Nb* |
4.4 |
2×1012 |
4.0 |
2×1012 |
4.7-5.1 |
3×1012 |
|
Nb(100) |
4.0 |
2×1012 |
3.6 |
2×1012 |
4.75 |
3×1012 |
|
Mo* |
3.8-4.1 |
3×1013 |
– |
– |
4.5 |
1.6×1013 |
|
Mo(100) |
4.6 |
3×1013 |
3.7 |
1×1013 |
4.6 |
1.6×1013 |
|
W(111) |
4.0 |
2×1013 |
– |
– |
– |
– |
|
Cu(111) |
2.4 |
1×1013 |
– |
– |
– |
– |
|
Si(111) |
1.7 |
– |
– |
– |
– |
– |
|
Pt(100) |
– |
– |
– |
– |
2.35 |
5×1012 |
Примечание: * - поликристаллическая структура
В
состоянии термодинамического равновесия скорости процессов адсорбции и
десорбции одинаковы. Предположим, что концентрация частиц сорта Aв газовой фазе составляет ![]() , а общий процесс описывается следующей
схемой:
, а общий процесс описывается следующей
схемой:
| (10) |
Обозначим
через ![]() поверхностную
плотность центров адсорбции, тогда
поверхностную
плотность центров адсорбции, тогда ![]() - плотность центров адсорбции, покрытых
адсорбированными молекулами, а величина
- плотность центров адсорбции, покрытых
адсорбированными молекулами, а величина ![]() определяет количество свободных центров.
Соответственно, для плотностей потоков адсорбирующихся и десорбирующихся частиц
можно записать
определяет количество свободных центров.
Соответственно, для плотностей потоков адсорбирующихся и десорбирующихся частиц
можно записать
| (11) |
| (12) |
Приравнивая ![]() получим
получим
| (13) |
 |
(14) |
где ![]() . Выражение (3.24)
представляет собой уравнение изотермы адсорбции Лангмюра.
. Выражение (3.24)
представляет собой уравнение изотермы адсорбции Лангмюра.
Рассмотрим теперь ситуацию, когда адсорбционно-десорбционные процессы сопровождаются химической реакцией ХАЧ с поверхностью. Простейшая схема такого процесса может быть представлена как
| (15) |
| (16) |
где индекс ![]() соответствует нахождению
частицы в газовой фазе. Стационарное балансное уравнение для степени заполнения
поверхности частицами (включая адсорбированные ХАЧ и продукты взаимодействия)
запишется в виде
соответствует нахождению
частицы в газовой фазе. Стационарное балансное уравнение для степени заполнения
поверхности частицами (включая адсорбированные ХАЧ и продукты взаимодействия)
запишется в виде
| (17) |
а его решением будет
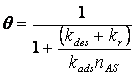 |
(18) |
где ![]() - концентрация частиц
- концентрация частиц ![]() у поверхности. Последняя
величина может быть найдена из условия равенства плотностей потоков частиц
у поверхности. Последняя
величина может быть найдена из условия равенства плотностей потоков частиц ![]() из объема плазмы к
поверхности и продуктов реакции с поверхности в газовую фазу:
из объема плазмы к
поверхности и продуктов реакции с поверхности в газовую фазу:
| (19) |
где ![]() - концентрация ХАЧ в
объеме плазмы, а
- концентрация ХАЧ в
объеме плазмы, а ![]() и
и
![]() - эффективная
диффузионная длина и константа скорости диффузионной гибели нейтральных частиц,
соответственно. Подходы к расчету
- эффективная
диффузионная длина и константа скорости диффузионной гибели нейтральных частиц,
соответственно. Подходы к расчету ![]() и
и ![]() определяются диапазоном рабочих давлений
реактора. В области высоких давлений, при
определяются диапазоном рабочих давлений
реактора. В области высоких давлений, при ![]() можно полагать
можно полагать ![]() , при этом
, при этом ![]() . В области средних давлений, когда длина
свободного пробега нейтральных частиц соизмерима с характерными размерами
реактора,
. В области средних давлений, когда длина
свободного пробега нейтральных частиц соизмерима с характерными размерами
реактора, ![]() (
(![]() - объем рабочей камеры реактора,
- объем рабочей камеры реактора,
![]() - площадь
внутренней поверхности), а
- площадь
внутренней поверхности), а ![]() . Для области низких давлений, при
. Для области низких давлений, при ![]() , транспорт частиц к
поверхности не является диффузионным. В этом случае также имеем
, транспорт частиц к
поверхности не является диффузионным. В этом случае также имеем ![]() , но
, но ![]() , где
, где ![]() . Решая (19) относительно
. Решая (19) относительно ![]() , подставляя результат в (18)
и выражая скорость образования газообразного продукта
, подставляя результат в (18)
и выражая скорость образования газообразного продукта ![]() как
как ![]() получим выражение, связывающее скорость
целевого процесса с концентрацией ХАЧ в объеме плазмы. Данное выражение
является достаточно громоздким, поэтому представление его в полном виде не
наглядно и поэтому вряд ли целесообразно. Для наглядности рассмотрим два
предельных случая, когда это уравнение трансформируется в более простые формы:
получим выражение, связывающее скорость
целевого процесса с концентрацией ХАЧ в объеме плазмы. Данное выражение
является достаточно громоздким, поэтому представление его в полном виде не
наглядно и поэтому вряд ли целесообразно. Для наглядности рассмотрим два
предельных случая, когда это уравнение трансформируется в более простые формы:
- Низкие давления:
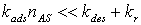 . Для данного режима
выражение (18) может быть переписано как
. Для данного режима
выражение (18) может быть переписано как 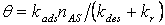 , откуда ясно, что
, откуда ясно, что 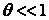 . Скорость реакции описывается
кинетическим уравнением первого порядка
. Скорость реакции описывается
кинетическим уравнением первого порядка
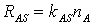
, где 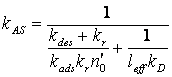
(20) 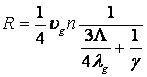
(21) Нетрудно видеть, что уравнение (20) является аналогом соотношения (21), в котором все возможные кинетические характеристики взаимодействия были объединены в один макропараметр – вероятность взаимодействия
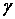 . Очевидно также, что
скорость реакции чувствительна к параметрам, определяющим концентрацию ХАЧ в
газовой фазе – скорости потока газа через реактор, давлению газа и мощности,
вкладываемой в разряд. Влияние процессов адсорбции и десорбции также может
отражаться на энергии активации взаимодействия ХАЧ с поверхностью. Поэтому
часто энергия активации химической реакции, определяемая из температурной
зависимости скорости травления, является не истинной, а кажущейся. Для случая,
когда травление материала обеспечивается ХАЧ одного вида, которые слабо
адсорбируются на поверхности и когда любые процессы с продуктами травления не
являются тормозящими, связь между истинной
. Очевидно также, что
скорость реакции чувствительна к параметрам, определяющим концентрацию ХАЧ в
газовой фазе – скорости потока газа через реактор, давлению газа и мощности,
вкладываемой в разряд. Влияние процессов адсорбции и десорбции также может
отражаться на энергии активации взаимодействия ХАЧ с поверхностью. Поэтому
часто энергия активации химической реакции, определяемая из температурной
зависимости скорости травления, является не истинной, а кажущейся. Для случая,
когда травление материала обеспечивается ХАЧ одного вида, которые слабо
адсорбируются на поверхности и когда любые процессы с продуктами травления не
являются тормозящими, связь между истинной 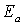 и кажущейся
и кажущейся 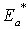 энергиями активации определится как
энергиями активации определится как 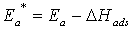 , где
, где 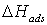 - теплота адсорбции ХАЧ. Когда
адсорбция ХАЧ слабая, а продукта реакции – сильная, то
- теплота адсорбции ХАЧ. Когда
адсорбция ХАЧ слабая, а продукта реакции – сильная, то 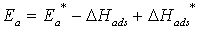 , где
, где 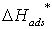 - теплота адсорбции продукта реакции.
- теплота адсорбции продукта реакции. -
Высокие давления:
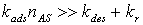 . В этом режиме
. В этом режиме 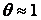 и
и 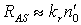 . Скорость реакции ХАЧ с
поверхностью не зависит от концентрации ХАЧ в газовой фазе, то есть имеет
нулевой кинетический порядок по концентрации ХАЧ в газовой фазе. Этот режим не
является типичным для процессов плазмохимической обработки материалов в условиях
ННГП.
. Скорость реакции ХАЧ с
поверхностью не зависит от концентрации ХАЧ в газовой фазе, то есть имеет
нулевой кинетический порядок по концентрации ХАЧ в газовой фазе. Этот режим не
является типичным для процессов плазмохимической обработки материалов в условиях
ННГП.